青书学堂兰州石化职业技术大学无机及分析化学(高起专)网上考试答案
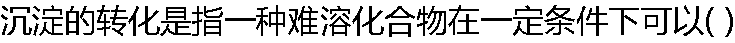 |
| A:被溶解 B:被分解 C:变成另一种易溶化合物 D:变成另一难溶化合物 |
|
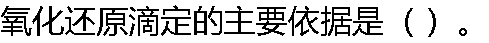 |
| A: 滴定过程中氢离子浓度发生变化 B: 滴定过程中金属离子浓度发生变化 C:滴定过程中电极电位发生变化 D: 滴定过程中有络合物生成 |
|
 |
| A:H2O2 B:H2SO4 C:HClO4 D:KMnO4 |
|
 |
| A:Qsp gt;Ksp B:Qsp lt;Ksp C:Qsp= Ksp D:以上都不对 |
|
 |
| A:先慢后快 B:先快后慢 C:忽快忽慢 D:保持慢速 |
|
| 测定水中钙硬度时,消除Mg 2 +的干扰可用( )。 |
| A: 控制酸度法 B: 配位掩蔽法 C: 氧化还原掩蔽法 D:沉淀掩蔽法 |
|
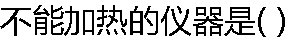 |
| A: 锥形瓶 B:烧杯 C:试管 D:容量瓶 |
|
 |
| A: 铬酸钾 B: 铁铵矾 C:吸附指示剂 D: 自身指示剂 |
|
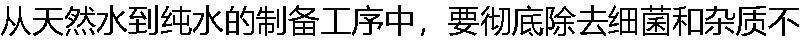 可采用的方法是( )。 可采用的方法是( )。 |
| A:紫外光照射 B:超滤 C:通CI2气 D:皆不可 |
|
 |
| A:热过滤与常压过滤法的操作基本不相同 B:减压过滤采用普通玻璃漏斗 C:热过滤漏斗采用长颈漏斗 D:减压抽滤装置包括过滤器、抽滤瓶、缓冲瓶和抽气泵 |
|
某一弱酸强碱盐MA(其K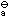 (HA)=1.0×10-5),则MA的标准水解常数K (HA)=1.0×10-5),则MA的标准水解常数K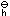 = ________。 = ________。 |
A:1.0×10-9; B:1.0×10-2;
C:1.0×10-19; D: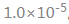 |
|
 |
| A:增大反应物之间的碰撞频率; B:降低了反应的活化能; C:提高了正反应的活化能; D:增大了平衡常数值; |
|
 的分析结果表达式合理的为( )。 的分析结果表达式合理的为( )。 |
| A:(25.48 plusmn; 0.1) % B:(25.48 plusmn; 0.13) % C:(25.48 plusmn; 0.135) % D:(25.48 plusmn; 0.1348) % |
|
| 下面有关配制、标定KMnO 4标准溶液的叙述,不正确的是( )。 |
| A: 溶液标定前需加热煮沸一定时间或放置数天 B:溶液必须用滤纸过滤除去MnO2 C: 必须保存在棕色瓶中 D:滴定时KMnO4溶液必须装在酸式滴定管中 |
|
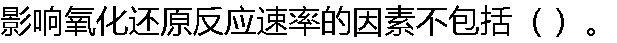 |
| A: 反应物浓度 B: 温度 C: 催化剂 D:平衡常数的大小 |
|
| 当利用莫尔法测定Cl –含量时,要求介质的pH值在6.5~10.5之间,若酸度过高,则( )。 |
| A: AgCl 沉淀不完全 B:AgCl沉淀吸附Cl–能力增强 C:Ag2CrO4 沉淀不易形成 D:形成Ag2O沉淀 |
|
| 在柠檬酸铵掩蔽Mg 2+的条件下进行CaC 2O 4沉淀,经陈化后的CaC 2O 4中发现有MgC 2O 4。这是由于( )。 |
| A: 表面吸附 B:后沉淀 C: 机械吸留 D: 混晶 |
|
 |
| A:先开抽气泵再往干滤纸上加水 B:先往干滤纸上加水再开抽气泵 C:先开抽气泵再往湿滤纸上加溶液 D:先往湿滤纸上加溶液再开抽气泵。 |
|
 |
| A:有一定的几何外形 B:有固定的熔点 C:各向异性 D:ABC三个选项都对 |
|
 |
| A: 温度勿高 B:充分振摇 C: 避免光照 D: 控制酸度 |
|
| H 3PO 4的pK a1=2.12,pK a2=7.2,pK a3=12.36。当pH=10时,磷酸溶液中的主要存在形式是( )。 |
| A:H3PO4 B:H2PO4- C:HPO42- D:PO43- |
|
 ) ) |
| A:NaOH水溶液 B: 氯仿 C: 苯酚 D: 乙醇 |
|
 ?( ) ?( ) |
| A:分馏 B:常压蒸馏 C:间歇式萃取法 D:连续式萃取法 |
|
 是( )。 是( )。 |
| A:游离指示剂的颜色 B: EDTA-M络合物的颜色 C: 指示剂-M络合物的颜色 D: 上述A+B的混合色 |
|
 。 。 |
| A:常用浓度为0.1~0.5mol/L B: 通常储存在塑料瓶中 C: 它不是基准试剂,常用ZnO、Zn、CaCO3等基准物质来标定 D: 可以存放在硬质玻璃试剂瓶中 |
|
已知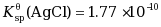 ,AgCl在0.01mol·L-1NaCl溶液中的溶解度(mol·L-1)为 ( ) ,AgCl在0.01mol·L-1NaCl溶液中的溶解度(mol·L-1)为 ( ) |
| A:1.77×10-10 B:1.33×10-5 C:0.001 D:1.77×10-8 |
|
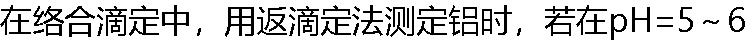 时,以某金属离子标准溶液返滴定过量的EDTA,最合适的金属离子标准溶液应该是( )。 时,以某金属离子标准溶液返滴定过量的EDTA,最合适的金属离子标准溶液应该是( )。 |
| A:Mg2+ B:Zn2+ C:Ag+ D:Bi3+ |
|
 。 。 |
| A:偶然误差 B:系统误差 C:随机误差 D:过失误差 |
|
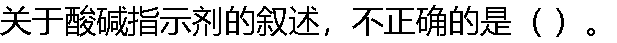 |
| A:实际变色范围可能会与理论变色范围有差异 B:指示剂的变色范围越窄,指示变色越敏锐 C:对于单色指示剂,随着指示剂用量的增加,其变色范围向pH增大的方向发生移动 D:指示剂在滴定终点颜色的改变尽量是无色→有色、浅色→有色 |
|
 |
| A:离子积 B:溶解度 C:溶度积 D:解离度 |
|
| 在酸性介质中,KMnO4的主要还原产物是( ) |
| A:MnO42- B:Mn C:Mn2+ D:MnO2 |
|
 |
| A:反应必须定量完成 B:反应必须有颜色变化 C:滴定剂与被测物必须是1:1反应 D:滴定剂必须是基准物 |
|
 |
| A: 滴定开始前 B: 滴定开始后 C:滴定至近终点时 D: 滴定至红棕色褪尽至无色时 |
|
| 对于某特定的酸碱体系而言,分布系数δ值( )。. |
| A:只取决于该体系的[H+]或pH值 B:只取决于该体系的总浓度с C:既要考虑体系的[H+],又要考虑该体系的c D:只取决于该体系的离解常数 |
|
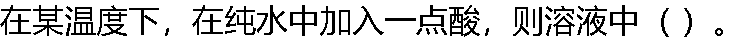 |
| A:[H+][OH-]的乘积增大 B:[H+][OH-]的乘积减小 C:[H+][OH-]的乘积不变 D:水的质子自递常数增加 |
|
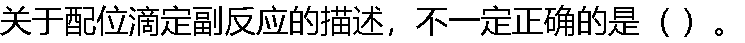 |
| A: 副反应的发生会影响主反应发生的程度 B: 副反应的发生程度以副反应系数加以描述 C:副反应的发生不利于配位滴定反应进行地更完全 D: 副反应的发生往往很难避免 |
|
 |
| A: 指示剂与金属离子生成的络合物不稳定 B: 被测溶液的酸度过高 C:指示剂与金属离子生成的络合物稳定性大于MY的稳定性 D: 指示剂与金属离子生成的络合物稳定性小于MY的稳定性 |
|
 |
| A: 天蓝 B: 黑色 C: 白色 D:深绿 |
|
 |
| A:对照实验 B:用两组测量数据对照 C:增加平行测量次数 D:进行仪器校准 |
|
| 用0.1000 mol/L的NaOH标准溶液滴定同浓度的HAc(pK a=4.74)的实验中,滴定的突跃范围为7.7~9.7;若用0.1000mol/L的NaOH 标准溶液去滴定某弱酸(HB)时(pK a=2.74), 此时的滴定突跃范围将是( )。 |
| A:8.7~10.7 B:6.7~9.7 C:6.7~10.7 D:5.7~9.7 |
|
 度慢,稍后,反应速度明显加快,起催化作用的是( )。 度慢,稍后,反应速度明显加快,起催化作用的是( )。 |
| A: 氢离子 B:MnO4- C:Mn2+ D:CO2 |
|
| 某弱酸HA的Ka=1.0×10-4,则其1mol/L水溶液的pH值为 ( ) |
| A:2.0; B:3.0; C:4.0; D:6.0; |
|
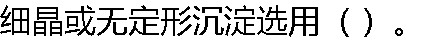 |
| A:慢速滤纸 B:中速滤纸 C:快速滤纸 D:普通滤纸 |
|
 时,应在下列何种条件下进行( ) 时,应在下列何种条件下进行( ) |
| A:酸性 B:弱酸性 C:碱性 D:弱碱性 |
|
| 在 NH3H2O 溶液中, 加入少量的固体NH4Cl,则溶液的pH 值将: __________. |
| A:变大 B:变小 C:不变 D:不能确定 |
|
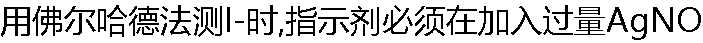 3溶液后才能加入,这是因为:( ) 3溶液后才能加入,这是因为:( ) |
| A:AgI对指示剂的吸附性强 B:对I-的吸附性强 C:Fe3+氧化I- D:Fe3+水解 |
|
 |
| A:增大; B:减小; C:无影响; D:先增大,后减小。 |
|
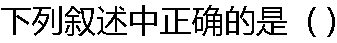 |
| A:反应物的转化率不随浓度的变化而变化 B:一种反应物的转化率随另一种反应物的起始浓度而变 C:平衡常数不随温度变化 D:平衡常数随起始浓度不同而变化 |
|
| CaF 2在pH=3.0时,比在pH=4.0时的溶解度大。其原因是( )。 |
| A: 盐效应 B: 配位效应 C:酸效应 D: 同离子效应 |
|
 |
| A:NH3和NH4CI; B:H2PO4—和HPO42—; C:HCl和过量的氨水; D:氨水和过量HCI |
|
 |
| A: Zn B:Mg C:CaCO3 D: ZnO |
|
| 配制SnCl2溶液应该加入( )以防止氧化 |
| A:铁 B:锡 C:铜 D:铝 |
|
 段的水称为二次水。制取时必须弃去( )。 段的水称为二次水。制取时必须弃去( )。 |
| A:头、尾各1/3容积的水 B:头、尾各1/5容积的水 C:开头制备的1/4容积的水 D:头、尾各1/4容积的水 |
|
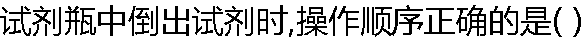 |
| A:标签背对手心 B:标签朝向手心 C:标签侧对手心 D:标签方向无所谓 |
|
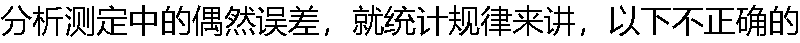 是( )。 是( )。 |
| A:多次平行测量数据符合正态分布 B:数值随机可变 C:大误差出现的概率小,小误差出现的概率大 D:数值相等的正、负误差出现的概率均等 |
|
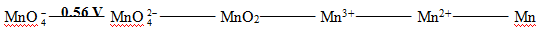
由上述电势图判断其中不能稳定存在可发生歧化的是 ( ) |
A:Mn3+ 和Mn2+ B:Mn3+ 和MnO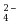 C:Mn3+ 和MnO2 D:MnO2和MnO C:Mn3+ 和MnO2 D:MnO2和MnO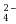 |
|
 |
| A:离子浓度的乘积小于KSP的先沉淀出来 B:沉淀时所需沉淀剂浓度小者先沉淀出来 C:溶解度小的物质先沉淀 D:被沉淀离子浓度大的先沉淀 |
|
 mol/L HCl时,pH突跃范围为4.30 ~9.70,若用1.000 mol/L NaOH滴定1.000 mol/L HCl时,pH突跃范围为( )。 mol/L HCl时,pH突跃范围为4.30 ~9.70,若用1.000 mol/L NaOH滴定1.000 mol/L HCl时,pH突跃范围为( )。 |
| A:3.30~10.70 B:5.30~8.70 C:3.30~7.00 D:4.30~7.00 |
|
 |
| A:F-强大的配位能力 B:SiF4具有挥发性 C:HF酸性强于H2SiO3 D:A、B共同作用的结果 |
|
 |
| A:条件稳定常数是实验条件下的实际稳定常数 B: 酸效应系数并不总是使条件稳定常数减小 C: 所有的副反应均使条件稳定常数减小 D: 条件稳定常数与配位滴定突跃无关 |
|
| AgCl在1molL1KNO 3中比在纯水中的溶解度小,其原因是( )。 |
| A: 配位效应 B:盐效应 C: 同离子效应 D: 酸效应 |
|
 |
| A: 甲基橙 B: 铬黑T C:二苯胺磺酸钠 D: 铁铵矾 |
|
 |
| A:n=3, l=2, m=0 ms=+1/2 B:n=4, l=-1, m=3 ms=+1/2 C:n=4, l=1, m=-2 ms=-1/2 D:n=3, l=3, m=-3 ms=-1/2 |
|
 |
| A: 一般来讲,物质溶解度随温度增高而增加 B:同一个沉淀物,其小颗粒的溶解度小于大颗粒 C: 同一沉淀物,其表面积愈大溶解度愈大 D: 沉淀反应中的陈化作用,对一样大小的沉淀颗粒不起作用 |
|
 |
| A:克氏烧瓶内所装试样量应大于瓶容积的1/2 B:旋开三通管螺旋夹,加热水蒸气发生器至沸腾,可加适量助沸剂 C:当三通管向外喷气,关冷凝水,开螺旋夹,不向克氏烧瓶试液中通气 D:当蒸馏完毕时,应先开螺旋夹,再停止加热 |
|
| 为使反应 A 2 + + B 4 + = A 3 + + B 3 +完全度达到99.9%,两电对的条件电位之差至少大于( )。 |
| A: 0.1 V B: 0.12 V C:0.35 V D: 0.18 V |
|
| 下列哪些溶液需用棕色瓶盛放:①K2Cr2O7②KMnO4③AgNO3④EDTA( ) |
| A: ①② B: ①③ C: ②③ D: ③④ |
|
| 已知一AB型难溶电解质和A2B型电解质的Ksp均为10-16则( ) |
| A:前者溶解度大于后者; B:前者溶解度小于后者; C:前者溶解度等于后者; D:无法确定。 |
|
 ,还有( )。 ,还有( )。 |
| A:基准Na2CO3 B:草酸 C:硼砂 D:盐酸 |
|
 直接准确滴定的是( )。 直接准确滴定的是( )。 |
| A:HCOOH(pKa=3.45) B:H3BO3(pKa=9.22) C:NH4NO3(pKb=4.74) D:H2O2(pKa=12) |
|

