青书学堂兰州石化职业技术大学物理化学(高起专)网上考试答案
 有( ) 有( ) |
| A:=0,=0 B:≠0,=0 C:=0,≠0 D:≠0,≠0 |
|
| 通常称为表面活性剂的物质就是指当其加入于液体中后 |
| A:能降低液体表面张力 B:能增大液体表面张力 C:不影响液体表面张力 D:能显著降低液体表面张力 |
|
 |
| A: 单组分两相平衡,气相体积》液相体积 B: 气体近似为理想气体,相变热不随温度而变 C: 单组分两相平衡,气相体积《液相体积,气体近似为理想气体,相变热不随温度而变 D:单组分两相平衡,气相体积》液相体积,气体近似为理想气体,相变热不随温度而变 |
|
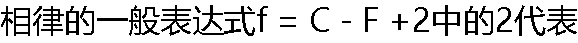 ? ? |
| A:2代表影响相平衡的外界条件为T和p两个因素 B: 2代表影响相平衡的外界条件为T因素 C: 2代表影响相平衡的外界条件为p因素 D: 2代表影响相平衡的外界条件为T和e两个因素 |
|
| 液体在毛细管中上升的高度与下列哪一个因素无关? |
| A:温度 B:液体密度 C:重力加速度 D:大气压力 |
|
| 动力学研究中,任意给定的化学反应 A + B → 2D ,是 |
| A:表明为二级反应 B:表明是双分子反应 C:表示了反应的计量关系 D:表明为基元反应 |
|
| 理想气体绝热向真空膨胀,则 |
| A:
ΔS=0 ,W=0 B:ΔH=0 ,ΔU=0 C: ΔG=0 ,ΔH=0 D: ΔU=0 ,ΔG=0 |
|
 |
| A:体积差ΔmixV =0,熵变ΔmixS > 0 B: 体积差ΔmixV<0,熵变ΔmixS= 0 C: 体积差ΔmixV =0,熵变ΔmixS< 0 D: 体积差ΔmixV >0,熵变ΔmixS > 0 |
|
| 有四种浓度均为 0.01 mol·kg -1 的电解质溶液,其中平均活度因子最大的是 |
| A:KCl B:CaCl2 C:Na2SO4 D:AlCl3 |
|
| 某理想气体进行绝热自由膨胀,其热力学能和焓的变化为( ) |
A: B: B: C: C: D: D: |
|
| 水中加入表面活性剂后将发生 |
A: ,正吸附 B: ,正吸附 B: ,负吸附 C: ,负吸附 C: ,正吸附 D: ,正吸附 D: ,负吸附 ,负吸附 |
|
| * 在一般情况下,电位梯度只影响 ( ) |
| A:离子的电迁移率 B:离子的迁移速率 C:电导率 D:离子承担的电流分数 |
|
| 298.15K、P?下液态水的化学势μ(l),水蒸汽的化学势μ(g),则( ) |
| A:μ(l) = μ(g) B:μ(l) < μ(g) C:μ(l) > μ(g) D:μ(l) ≠ μ(g) |
|
| * 将克拉佩龙方程用于H 2 O(l)和H 2 O(s)两相平衡,随着压力的增长,H 2 O的凝固点将 ( ) |
| A:上升 B:下降 C:不变 D:无法判断 |
|
| * 单组分系统相图可以根据克-克方程和克拉佩龙方程来绘制,其中克-克方程适合下列过程的是 ( ) |
| A:I2(s)→I2(g) B:C(石墨)→C(金刚石) C:Hg2Cl2(s)→2HgCl(g) D:N2(g, T1, p1)→N2(g, T2, p2) |
|
| 某反应 , 无论反应物初始浓度为多少 , 在相同时间和温度时 , 反应物消耗的浓度为定值 ,此反应是 |
| A:负级数反应 B:一级反应 C:零级反应 D:二级反应 |
|
| 已知H2的临界温度tc = -239.9℃,临界压力pc=1.297×103kPa 。有一氢气瓶,在-50℃时瓶中的H2,压力为12.16×103kPa,则H2一定是( )态。 |
| A:气 B:液 C:气液两相平衡 D:无法确定 |
|
 |
| A:f = C - F +3 B: f = C+ F +3 C: f = C - F-3 D: f = C - F |
|
| 一个电池反应确定的电池, E 值的正或负可用来说明 |
| A:电池是否可逆 B:电池反应自发进行的方向和限度 C:电池反应自发进行的方向 D:电池反应是否达到平衡 |
|
| * 稀溶液的依数性包括蒸 气 压下降、沸点升高、凝固点降低和渗透压,下面的陈述都与它们有关 , 其中正确的是 ( ) |
| A:只有溶质不挥发的稀溶液才有这些依数性 B:所有依数性都与溶液中溶质的浓度成正比 C:所有依数性都与溶剂的性质无关 D:所有依数性都与溶质的性质有关 |
|
 5kPa 的液体水完全蒸发为100℃,101.325kPa的水蒸气,此过程△S和△A分别有( ) 5kPa 的液体水完全蒸发为100℃,101.325kPa的水蒸气,此过程△S和△A分别有( ) |
| A:=0,>0 B:>0, <0 C:=0, >0 D:>0,=0 |
|
| 应用能斯特方程计算出电池 E < 0 ,这表示电池的反应是 |
| A:不可能进行 B:反向自发进行 C:正向自发进行 D:反应方向不确定 |
|
| 使电解质溶液的平衡性偏离理想溶液的主要原因是 |
| A:电解质溶液能够导电 B: 电解质在溶液中只能部分电离 C:电解质溶液中的离子间存在静电引力 D:电解质溶液中的离子间存在分子引力 |
|
| * H 2 SO 4 与H 2 O可形成H 2 SO 4 · H 2 O(s)、H 2 SO 4 · 2H 2 O(s)与H 2 SO 4 · 4H 2 O(s)三种水合物,在 p q 下,能与硫酸水溶液和冰达平衡的硫酸水合物最多可有几种? ( ) |
| A:3 B:2 C:1 D:0 |
|
| * 某反应速率常数单位是 mol·l -1 ·s -1 , 该反应级数为 ( ) |
| A:3级 B:2级 C:1级 D:0级 |
|
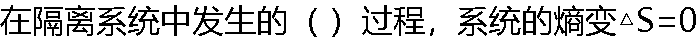 |
| A:任何 B:循环 C:可逆 D:不可逆 |
|
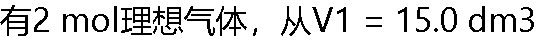 到V2 = 40.0 dm3,在298 K时,保持外压为100 kPa,做恒外压膨胀所做的功。 到V2 = 40.0 dm3,在298 K时,保持外压为100 kPa,做恒外压膨胀所做的功。 |
| A:-2.50 kJ B: 2.50kj C: -3kj D: 3kj |
|
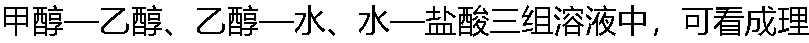 想溶液的是? 想溶液的是? |
| A: 乙醇—水 B:甲醇—乙醇 C: 水—盐酸 |
|
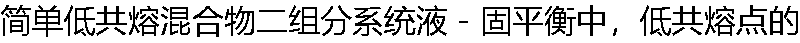 自由度f=? 自由度f=? |
| A: 1 B: 2 C: 3 D:0 |
|
| 某反应物反应了 3/4 所需时间是反应了 1/2 所需时间的 2 倍,则该反应级数为 |
| A:0级 B:1级 C:2级 D:3级 |
|
对于反应 ,如果反应物 A 的初始浓度减少一半, A 的半衰期增大 1 倍,则该反应为 ,如果反应物 A 的初始浓度减少一半, A 的半衰期增大 1 倍,则该反应为 |
| A:零级反应 B:一级反应 C:二级反应 D:三级反应 |
|
若恒温不做非体积功情况下,3mol 理想气体自273K吸热Q1,若2mol该气体同样自273K升温到283K,吸热Q2,则有( ) |
| A:Q1 > Q2
B:Q1 < Q2 C:Q1 = Q2 D:无法比较Q1和Q2大小
|
|
 度为? 度为? |
| A:0 B: 1 C: 2 D: 3 |
|
| 下列有关反应级数的说法中,正确的是 |
| A:反应级数只能是大于零的数 B: 具有简单级数的反应都是基元反应 C:反应级数等于反应分子数 D:反应级数不一定是正整数 |
|
| 涉及稀溶液依数性的下列表述中不正确的是 |
| A:在通常实验条件下依数性中凝固点降低是最灵敏的一个性质 B:用热力学方法推导依数性公式时都要应用拉乌尔定律 C:凝固点公式只适用于固相是纯溶剂的系统 D:依数性都可以用来测定溶质的相对分子量 |
|
 |
| A:隔离系统无论热河变化,其能量守恒 B:热不能自动低温物体传给高温物体而不产生其他变化 C:如果A,B的温度T相同,B与C的温度相同,则A与C的温度相同 D:在两个不同温度的热源之间工作的所有热机,以可逆热机效率最高 |
|
| 若已知某反应的△rCp,m=0,则当温度升高时该反应的△rSθm( ) |
| A:不能确定 B:增大 C:减小 D:不变 |
|
| NH4HCO3(s)在真空容器中发生分解反应:NH4HCO3 (s) = NH3(g) + H2O(g)+CO2(g),并达到平衡,则该反应体系( ) |
| A:Φ = 4,C = 1,f = 1 B:Φ = 3,C = 3,f = 2 C:Φ = 2,C = 2,f = 2 D:Φ = 2,C = 1,f = 1 |
|
| 下列说法中不正确的是 |
| A:平面液体没有附加压力 B:凸液面曲率半径为正,凹液面曲率半径为负 C:弯曲液面表面张力的方向指向曲率中心 D:弯曲液面的附加压力方向指向曲率中心 |
|
| * 三相点是 ( ) |
| A:某一温度,超过此温度,液相就不能存在 B:通常发现在很靠近正常沸点的某一温度 C:液体的蒸气压等于25℃时的蒸气压三倍数值时的温度 D:固体、液体和气体可以平衡共存时的温度和压力 |
|
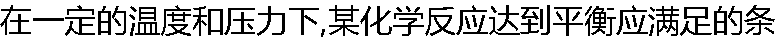 件是( ) 件是( ) |
| A:ΔG?=0 B:ΔG=0 C:ΔG=ΔG? D:ΔG?=-RTlnk? |
|
 |
| A:不可能增大 B:不可能减小 C:可以增大可以减小 D:始终不变 |
|
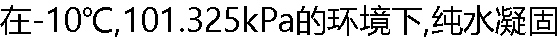 成冰,则此过程有( ) 成冰,则此过程有( ) |
| A:μ(冰)<μ(水) B:μ(冰)=μ(水) C:μ(冰)>μ(水) D:不能确定 |
|
| * 固体Fe、FeO、Fe 3 O 4 与CO、CO 2 达到平衡时,其独立化学平衡数 R , 组分数 C 和自由度数 F 分别为 ( ) |
| A:R = 3, C = 2, F = 0 B:R = 4, C = 1, F = 1 C:R = 1, C = 4, F = 2 D:R = 2, C = 3, F = 1 |
|
| * 在农药中通常要加入一定量的表面活性剂物质,如烷基苯磺酸盐,其主要目的是 ( ) |
| A:增加农药的杀虫性 B:提高农药对植物表面的润湿能力 C:防止农药挥发 D:消除药液的泡沫 |
|
| 天空中的水滴大小不等,在运动中,这些水滴的变化趋势如何? |
| A:大水滴分散成小水滴,半径趋于相等 B:大水滴变大,小水滴缩小 C:大小水滴的变化没有规律 D:不会产生变化 |
|
 ibbs函数,二种组分的物质的量分别是n1和n2,则体系的Gibbs函数G为? ibbs函数,二种组分的物质的量分别是n1和n2,则体系的Gibbs函数G为? |
| A:G = n1G1 + n2G2 B: G = n2G1 + n2G2 C: G= n2G1 - n2G2 D: G = n2G1 + n2G2 |
|
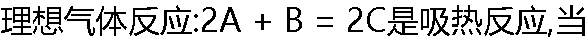 反应达到平衡时,可采用哪组条件,使平衡向右移动( ) 反应达到平衡时,可采用哪组条件,使平衡向右移动( ) |
| A:降低温度和降低总压 B:升高温度和增大总压 C:升高温度和降低总压 D:降低温度和增大总压 |
|
 t定律? t定律? |
| A:pB= xB? B: pB= xB+pB* C: pB= xB-pB* D: pB= xB/pB* |
|
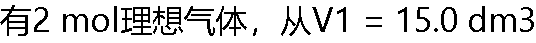 到V2 = 40.0 dm3,经下在298 K时恒温可逆膨胀,所做的功。 到V2 = 40.0 dm3,经下在298 K时恒温可逆膨胀,所做的功。 |
A: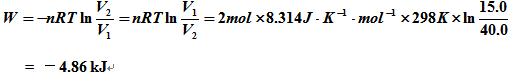 B: B: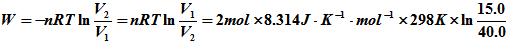 =-4.56kj C: 4.86kj D: 4.88kj =-4.56kj C: 4.86kj D: 4.88kj |
|
 ) ) |
| A:正确 B:错误 |
|
 分别都处于各自所选定的标准态,是错误的。 分别都处于各自所选定的标准态,是错误的。 |
| A:正确 B:错误 |
|
 的平衡组成。( ) 的平衡组成。( ) |
| A:正确 B:错误 |
|
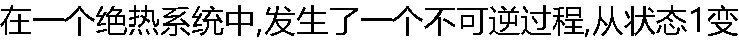 到状态2,不论用什么方法,系统再也回不到原来状态了。( ) 到状态2,不论用什么方法,系统再也回不到原来状态了。( ) |
| A:正确 B:错误 |
|
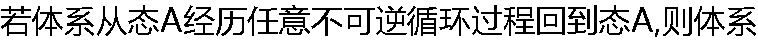 的熵变可能大于零,也可能小于零。( ) 的熵变可能大于零,也可能小于零。( ) |
| A:正确 B:错误 |
|
 |
| A:正确 B:错误 |
|
设高低温热源的温度分别是T1和T2,则Carnot热机的效率η为  。 。 |
| A:正确 B:错误 |
|
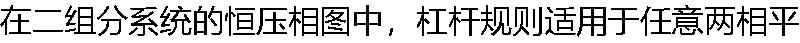 衡区。 衡区。 |
| A:正确 B:错误 |
|
| 虽然ΔU = Qv,但U是状态函数,而Qv不是状态函数。( ) |
| A:正确 B:错误 |
|
封闭系统热力学第一定律的数学表达式为  。 。 |
| A:正确 B:错误 |
|
 B组分也在该区间服从拉乌尔定律。( ) B组分也在该区间服从拉乌尔定律。( ) |
| A:正确 B:错误 |
|
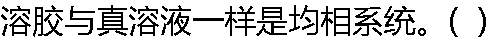 |
| A:正确 B:错误 |
|
封闭系统热力学第一定律的数学表达式为  。 。 |
| A:正确 B:错误 |
|
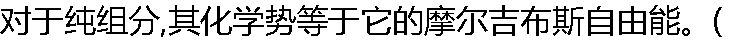 ) ) |
| A:正确 B:错误 |
|
热力学第二定律的数学表达式(Clausius不等式)的微分式是  。 。 |
| A:正确 B:错误 |
|
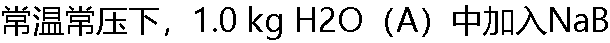 r(B),水溶液的体积(以cm3表示)与溶质B的质量摩尔浓度mB的关系可用下式表示: 求:当mB = 0.25 mol ? kg-1时,在溶液中NaBr(B)VB = 24.668 cm3 ? mol-1正确吗? r(B),水溶液的体积(以cm3表示)与溶质B的质量摩尔浓度mB的关系可用下式表示: 求:当mB = 0.25 mol ? kg-1时,在溶液中NaBr(B)VB = 24.668 cm3 ? mol-1正确吗? |
| A:正确 B:错误 |
|
 馏可同时得到两个纯组分。( ) 馏可同时得到两个纯组分。( ) |
| A:正确 B:错误 |
|
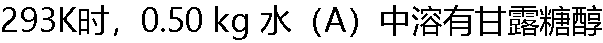 (B)2.597 × 10-2 kg,该溶液的蒸气压为2322.4 Pa。已知这该温度时,纯水的蒸气压为2334.5Pa。甘露糖醇的摩尔质量MB=0.181 kg ? mol-1,正确吗? (B)2.597 × 10-2 kg,该溶液的蒸气压为2322.4 Pa。已知这该温度时,纯水的蒸气压为2334.5Pa。甘露糖醇的摩尔质量MB=0.181 kg ? mol-1,正确吗? |
| A:正确 B:错误 |
|
 。( ) 。( ) |
| A:正确 B:错误 |
|
| 凡是ΔG gt;0的过程都不能进行。( ) |
| A:正确 B:错误 |
|

