青书学堂陇东学院成人高等学历教育学习平台物理化学实验(专升本)网上考试答案
| 水中加入表面活性剂后将发生 |
A: ,正吸附 B: ,正吸附 B: ,负吸附 C: ,负吸附 C: ,正吸附 D: ,正吸附 D: ,负吸附 ,负吸附 |
|
. 温度升高时,固体氧化物的分解压力(分解反应是吸热反应):( ) |
| A:降低; B:增大; C:恒定; D:无法确定 |
|
| 涉及稀溶液依数性的下列表述中不正确的是 |
| A:在通常实验条件下依数性中凝固点降低是最灵敏的一个性质 B:用热力学方法推导依数性公式时都要应用拉乌尔定律 C:凝固点公式只适用于固相是纯溶剂的系统 D:依数性都可以用来测定溶质的相对分子量 |
|
| 已知反应 2NH3= N2+ 3H2在等温条件下,标准平衡常数为 0.25,那么,在此条件下,氨的合成反应 (1/2) N2+(3/2) H2= NH3 的标准平衡常数为: ( ) |
| A:4 B:0.5 C:2 D:1 |
|
| 有四种浓度均为 0.01 mol·kg -1 的电解质溶液,其中平均活度因子最大的是 |
| A:KCl B:CaCl2 C:Na2SO4 D:AlCl3 |
|
对于反应 ,如果反应物 A 的初始浓度减少一半, A 的半衰期增大 1 倍,则该反应为 ,如果反应物 A 的初始浓度减少一半, A 的半衰期增大 1 倍,则该反应为 |
| A:零级反应 B:一级反应 C:二级反应 D:三级反应 |
|
 |
A: B: B: C: C: D: D: |
|
| 在T=380K,总压p=200 kPa条件下,反应:C6H5C2H5(g)= C6H5C2H3(g)+ H2(g)的平衡系统中,加 入一定量的惰性组分H2O(g),则反应的标准平衡常数K ( );C6H5C2H5(g)平衡转化率( )。 |
| A:减小,增大 B:增大,减小 C:不变,增大 D:不变,减小 |
|
| 涉及溶液表面吸附的说法中正确的是 |
| A:溶液表面发生吸附后表面自由能增加 B:溶液的表面张力一定小于溶剂的表面张力 C:定温下,表面张力不随浓度变化时,浓度增大,吸附量不变 D:饱和溶液的表面不会发生吸附现象 |
|
范德华方程式认为实际气体作为理想气体处理时,应引入的校正因子数目为( ) |
| A:4 B:3 C:2 D:1 |
|
| 298K、101.325kPa时反应:C6H6(l) + 7.5O2(g) → 3H2O(l) + 6CO2(g),若反应中各气体物质均可视为理想气体,则其等压反应热ΔrH?m与等容反应热ΔrU?m之差约为( ) |
| A:-3.7kJ B:1.2kJ C:-1.2kJ D:3.7kJ |
|
 |
A: B: B: C: C: D: D: |
|
| 对于平行反应,各反应的活化能不同,以下措施不能改变主、副产物比例的是 |
| A:提高反应温度 B:延长反应时间 C:加入适当的催化剂 D:降低反应温度 |
|
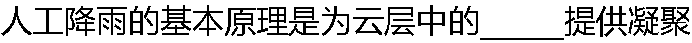 中心(如AgI颗粒)而使之成雨滴落下。 中心(如AgI颗粒)而使之成雨滴落下。 |
| A:过饱和水气 B: 水气 C: 云层 D: 云层和水气 |
|
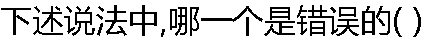 |
| A:通过相图可确定一定条件下体系由几相构成 B:相图可表示出平衡时每一相的组成如何 C:相图可表示出达到相平衡所需的时间长短 D:通过杠杆规则可在相图上计算各相的相对数量多少 |
|
 效率( ) 效率( ) |
| A:最大 B:最小 C:与其途径有关 D:不能确定 |
|
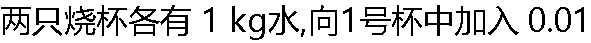 mol 蔗糖,向2号杯内溶入0.01 mol NaCl,两只烧杯按同样速度冷却降温,则有 ( ) mol 蔗糖,向2号杯内溶入0.01 mol NaCl,两只烧杯按同样速度冷却降温,则有 ( ) |
| A:1号杯先结冰 B:2号杯先结冰 C:两杯同时结冰 D:不能预测其结冰的先后次序 |
|
 ) ) |
| A:一定产生热交换 B:一定不产生热交换 C:不一定产生热交换 D:温度恒定与热交换无关 |
|
 |
| A:不具有确定组成 B:平衡时气相组成和液相组成相同; C:其沸点随外压的变化而变化 D:与化合物一样具有确定组成 |
|
、25℃时,CH4(g)在H2O(l)和C6H6(l)中的亨利系数分别为4.18′109Pa和57′106Pa ,则在相同的平衡气相分压p(CH4)下,CH4在水中与在苯中的平衡组成( ) |
| A:x(CH4,水) >x(CH4,苯) B:x(CH4,水) <x(CH4,苯) C:x(CH4,水) = x(CH4,苯) |
|
| 若已知某反应的△rCp,m=0,则当温度升高时该反应的△rSθm( ) |
| A:不能确定 B:增大 C:减小 D:不变 |
|
| 在下面涉及盖斯定律的表述中,?不正确的是 |
| A:对在等温等压且不做非体积功的条件下,?发生的各个化学反应过程和相变过程,?可使用盖斯定律 B:对在等温等容且不做功的条件下,?发生的各个化学反应过程,?可使用盖斯定律 C:同一物质在盖斯定律涉及的几个反应中都出现时,?只要无溶解等现象,?相态不同也可加减 D:利用盖斯定律求某个反应的热效应时可引入一些别的反应,设想一些中间步骤,?无论实际反应是否按这些中间步骤进行都可以 |
|
. 在a、b两相中都含有A和B两种物质,当达到相平衡时,下列三种情况正确的是( ) |
A: B: B: C: C: |
|
| 水中加入表面活性剂后将发生 |
A: ,正吸附 B: ,正吸附 B: ,负吸附 C: ,负吸附 C: ,正吸附 D: ,正吸附 D: ,负吸附 ,负吸附 |
|
对于反应 ,如果反应物 A 的初始浓度减少一半, A 的半衰期增大 1 倍,则该反应为 ,如果反应物 A 的初始浓度减少一半, A 的半衰期增大 1 倍,则该反应为 |
| A:零级反应 B:一级反应 C:二级反应 D:三级反应 |
|
| 理想气体绝热向真空膨胀,则 |
| A:
ΔS=0 ,W=0 B:ΔH=0 ,ΔU=0 C: ΔG=0 ,ΔH=0 D: ΔU=0 ,ΔG=0 |
|
*焓的定义式中  , 式中的P代表 ( ) , 式中的P代表 ( ) |
| A:体系的总压力 B:体系中各组分的分压 C:100kPa D:外压 |
|
| 使用熵判据?S≤0来判断过程的方向和限度时,所需的条件是( ) |
| A:恒温恒容非体积功为零 B:恒温恒压非体积功为零 C:隔离系统中发生的过程 D:绝热系统中发生的过程 |
|
 标准状态下单质的生成热都规定为零?(B)?化合物的生成热一定不为零 标准状态下单质的生成热都规定为零?(B)?化合物的生成热一定不为零 |
| A:标准状态下单质的生成热都规定为零 B:化合物的生成热一定不为零 C:很多物质的生成热都不能用实验直接测量 D:通常所使用的物质的标准生成热数据实际上都是相对值 |
|
| 使电解质溶液的平衡性偏离理想溶液的主要原因是 |
| A:电解质溶液能够导电 B: 电解质在溶液中只能部分电离 C:电解质溶液中的离子间存在静电引力 D:电解质溶液中的离子间存在分子引力 |
|
| 某反应无论反应物的起始浓度如何,完成 65% 反应的时间都相同,则反应的级数为 |
| A: 零级反应 B:一级反应 C: 二级反应 D:三级反应 |
|
 |
A: B: B: C: C: D: D: |
|
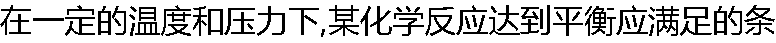 件是( ) 件是( ) |
| A:ΔG?=0 B:ΔG=0 C:ΔG=ΔG? D:ΔG?=-RTlnk? |
|
 |
| A:不可逆循环过程 B:可逆循环过程 C:两种理想气体的混合过程 D:纯液体的真空蒸发过程 |
|
 |
A: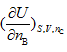
B: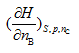
C: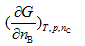
D: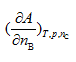 |
|
| 在732K时反应NH4Cl(s) = NH3(g) + HCl(g)的△rGmΘ为-20.8kJ. mol-1,△rHmΘ为154kJ·mol-1,则反应的△rSmΘ为: ( ) |
| A:239J·K-1·mol-1 B:0.239J·K-1·mol-1 C:82J·K-1·mol-1 D:0.182J·K-1·mol-1 |
|
| 天空中的水滴大小不等,在运动中,这些水滴的变化趋势如何? |
| A:大水滴分散成小水滴,半径趋于相等 B:大水滴变大,小水滴缩小 C:大小水滴的变化没有规律 D:不会产生变化 |
|
 =0 的过程应满足的条件是 =0 的过程应满足的条件是 |
| A:等温等压且非体积功为零的可逆过程 B:等温等压且非体积功为零的过程 C:等温等容且非体积功为零的过程 D:可逆绝热过程 |
|
. 液体在其T,p满足克-克方程的条件下进行汽化的过程,以下各物理量中不变的是:( ) |
| A:摩尔热力学能 B:摩尔体积 C:摩尔吉布斯函数 D:摩尔熵 |
|
| 温度恒定为T,一个刚性容器体积为V,其中还有理想气体A和B,它们物质的量、分压力、分体积分别为nA,pA,VA,和nB,PB,VB,总压力为p。下式正确的是( ) |
| A:pAV=nART B:pVB=(nA+nB)RT C:pAVA=nART D:pBVB=nBRT |
|
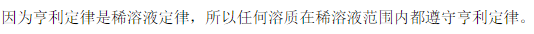 |
| A:正确 B:错误 |
|
 |
| A:正确 B:错误 |
|
热力学第二定律的数学表达式(Clausius不等式)的微分式是  。 。 |
| A:正确 B:错误 |
|
热力学第二定律的数学表达式(Clausius不等式)的微分式是  。 。 |
| A:正确 B:错误 |
|
 加大 ( ) 加大 ( ) |
| A:正确 B:错误 |
|
封闭系统热力学第一定律的数学表达式为  。 。 |
| A:正确 B:错误 |
|
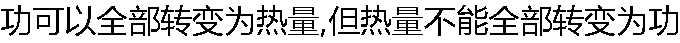 |
| A:正确 B:错误 |
|
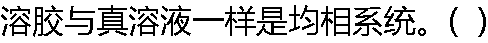 |
| A:正确 B:错误 |
|
 B组分也在该区间服从拉乌尔定律。( ) B组分也在该区间服从拉乌尔定律。( ) |
| A:正确 B:错误 |
|
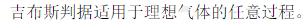 |
| A:正确 B:错误 |
|
封闭系统热力学第一定律的数学表达式为  。 。 |
| A:正确 B:错误 |
|
 |
| A:正确 B:错误 |
|
 |
| A:正确 B:错误 |
|
 ( ) ( ) |
| A:正确 B:错误 |
|
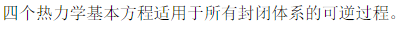 |
| A:正确 B:错误 |
|
 |
| A:正确 B:错误 |
|
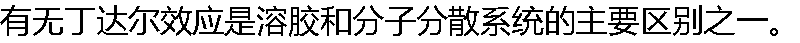 ( ) ( ) |
| A:正确 B:错误 |
|
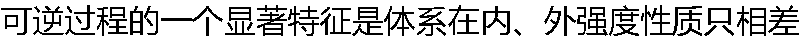 无限小的情况下发生。 无限小的情况下发生。 |
| A:正确 B:错误 |
|
 |
| A:正确 B:错误 |
|
 分别都处于各自所选定的标准态,是错误的。 分别都处于各自所选定的标准态,是错误的。 |
| A:正确 B:错误 |
|

